
題目列表(包括答案和解析)
| O | 2- 7 |
| 氫氧化物開(kāi)始沉淀時(shí)的pH | 氫氧化物開(kāi)始沉淀完全時(shí)的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |
| O | 2- 7 |
| O | 2- 7 |
| O | 2- 7 |
| O | 2- 7 |

| O | 2- 7 |
| O | 2- 7 |
| 分類標(biāo)準(zhǔn) | 能導(dǎo)電的物質(zhì) | 電解質(zhì) | 非電解質(zhì) |
| 屬于該類的物質(zhì) | / | / |
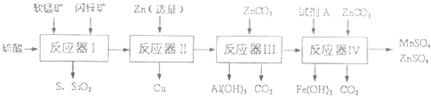
| 物質(zhì) | Fe(OH)3 | A1(OH)3 | Zn(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 開(kāi)始沉淀pH | 2.7 | 3.3 | 5.4 | 7.6 | 8.3 |
| 完全沉淀pH | 4.4 | 5.2 | 8.0 | 9.6 | 9.8 |
國(guó)際學(xué)校優(yōu)選 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com