
題目列表(包括答案和解析)
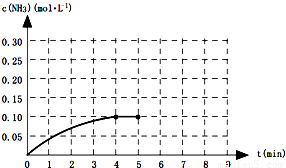
 一定溫度下,向一2L的恒容密閉容器內(nèi)加入0.2molN2和0.6mol H2,發(fā)生如下反應(yīng):N2(g)+3H2(g)?2NH3(g)△H<0.反應(yīng)中NH3的物質(zhì)的量濃度的變化的情況如圖所示:
一定溫度下,向一2L的恒容密閉容器內(nèi)加入0.2molN2和0.6mol H2,發(fā)生如下反應(yīng):N2(g)+3H2(g)?2NH3(g)△H<0.反應(yīng)中NH3的物質(zhì)的量濃度的變化的情況如圖所示:| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
國際學(xué)校優(yōu)選 - 練習(xí)冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com