
題目列表(包括答案和解析)
| 編號 | 5mlCu2+溶液(mol?L-1) | 10ml Br-溶液(mol?L-1) | 現(xiàn)象 |
| ① | 第一份CuSO4溶液 | a | 溶液由藍(lán)色變?yōu)樗{(lán)綠色 |
| ② | 第一份CuSO4溶液 | b | 溶液由藍(lán)色變?yōu)椴菥G色 |
| ③ | 第一份CuSO4溶液 | c | 溶液由藍(lán)色變?yōu)榱辆G色 |
| 編號 | 5mlCu2+溶液(mol?L-1) | 10ml Br-溶液(mol?L-1) | 現(xiàn)象 |
| ① | d | 第一份NaBr溶液 | 溶液由藍(lán)色變?yōu)樗{(lán)綠色 |
| ② | e | 第一份NaBr溶液 | 溶液由藍(lán)色變?yōu)椴菥G色 |
| ③ | f | 第一份NaBr溶液 | 溶液由藍(lán)色變?yōu)榱辆G色 |
| 編號 | 5mlCu2+溶液(mol?L-1) | 10ml Br-溶液(mol?L-1) | 溫度 | 現(xiàn)象 |
| ① | 第一份CuSO4溶液 | 第一份NaBr溶液 | 25℃ | 溶液由藍(lán)色變?yōu)樗{(lán)綠色 |
| ② | 第一份CuSO4溶液 | 第一份NaBr溶液 | 60℃ | 溶液由藍(lán)色變?yōu)椴菥G色 |
| ③ | 第一份CuSO4溶液 | 第一份NaBr溶液 | 75℃ | 溶液由藍(lán)色變?yōu)榱辆G色 |
| 編號 | 5mlCuSO4溶液 | 10mlNaBr溶液 (mol?L-1) |
現(xiàn) 象 |
| ① | 第一份CuSO4溶液 | a | 溶液由藍(lán)色變?yōu)樗{(lán)綠色 |
| ② | 第一份CuSO4溶液 | b | 溶液由藍(lán)色變?yōu)椴菥G色 |
| ③ | 第一份CuSO4溶液 | c | 溶液由藍(lán)色變?yōu)樯罹G色 |
| 編號 | 5mlCuSO4溶液 | 10mlNaBr溶液 (mol?L-1) |
現(xiàn) 象 |
| ① | d | 第一份NaBr溶液 | 溶液由藍(lán)色變?yōu)樗{(lán)綠色 |
| ② | e | 第一份NaBr溶液 | 溶液由藍(lán)色變?yōu)椴菥G色 |
| ③ | f | 第一份NaBr溶液 | 溶液由藍(lán)色變?yōu)樯罹G色 |
| 編號 | 5mlCuSO4溶液 | 10mlNaBr溶液 (mol?L-1) |
溫度 | 現(xiàn)象 |
| ① | 第一份CuSO4溶液 | 第一份NaBr溶液 | 25℃ | 溶液由藍(lán)色變?yōu)樗{(lán)綠色 |
| ② | 第一份CuSO4溶液 | 第一份NaBr溶液 | 60℃ | 溶液由藍(lán)色變?yōu)椴菥G色 |
| ③ | 第一份CuSO4溶液 | 第一份NaBr溶液 | 75℃ | 溶液由藍(lán)色變?yōu)樯罹G色 |
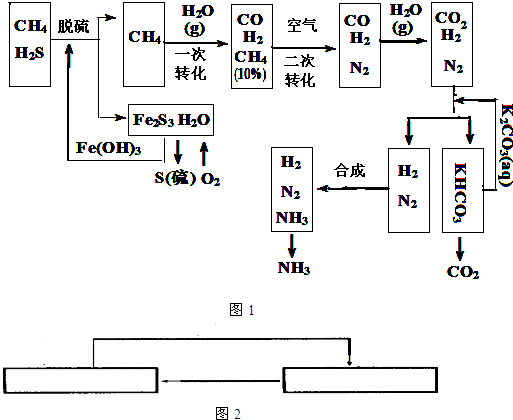
 合成氨工業(yè)對國民經(jīng)濟(jì)和社會(huì)發(fā)展具有重要的意義.其原理為:
合成氨工業(yè)對國民經(jīng)濟(jì)和社會(huì)發(fā)展具有重要的意義.其原理為:| c(H2)?c(CO) |
| c(H2O) |
| c(H2)?c(CO) |
| c(H2O) |
| 實(shí)驗(yàn)組別 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達(dá)到平衡所需時(shí)間/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
國際學(xué)校優(yōu)選 - 練習(xí)冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com